Folge 043 – Enthalpie (H) & Reaktionsenthalpie (∆H) | SW Teil 2 (PDF)
Inhalt der Folge:
- Wie wir bereits in Folge 042 gelernt haben, versteht man unter Stoffwechsel die chemischen Reaktionen in einem Organismus.
- Im Hinblick darauf ist es interessant zu wissen, wie man ganz allgemein beschreiben kann, ob eine chemische Reaktion freiwillig (ohne äußeren Zwang) ablaufen kann.
- Das Ganze lässt sich mit Hilfe der freien Enthalpie (G) beschreiben, die sich wiederum aus der Enthalpie (H) und der Entropie (S) zusammensetzt.
- In dieser Podcastfolge geht es speziell um die Enthalpie (H).
Thermodynamik – Die Lehre von Energie und Arbeit
- Die Thermodynamik ist ein Teil der klassischen Physik und beschäftigt sich mit den Zusammenhängen von Energie, Arbeit und Temperatur.
- Die Thermodynamik erlaubt auf Grundlage von ein paar Hauptsätzen und Zustandsgleichungen Aussagen darüber zu treffen, ob chemische Reaktionen aus energetischen Gründen möglich sind oder nicht.
- Ob eine chemischen Reaktionen aus energetischen Gründen freiwillig ablaufen kann oder nicht, wird in der Thermodynamik mit der freien Enthalpie (G) beschrieben.
Freie Enthalpie (G) bzw. Freie Reaktionsenthalpie (∆G)
- Die freie Enthalpie (G) ist ein Maß für die Triebkraft einer chemische Reaktion und liefert Informationen darüber, ob eine Reaktion freiwillig (ohne äußeren Zwang) ablaufen kann.
- Allerdings kann man die freie Enthalpie (G) eines Zustandes nicht messen, sondern nur die Änderung der freien Enthalpie zwischen zwei Zuständen, auch freie Reaktionsenthalpie (∆G) genannt.
- Die sogenannte Gibbs-Helmholtz-Gleichung zeigt uns, dass die Änderung der freien Enthalpie (∆G) von der Änderung der Enthalpie (∆H) und der Änderung der Entropie (∆S) im Verlauf einer chemischen Reaktion abhängt.

- In der heutigen Podcastfolge gucken wir uns den ersten Teil der Gleichung, also die Reaktionsenthalpie (∆H) genauer an!
Was ist Enthalpie (H) bzw. Reaktionsenthalpie (∆H)?
- Enthalpie (H) ist ein Maß für Wärmeenergie.
- Allerdings kann man die Enthalpie (H) eines Zustandes nicht messen, sondern nur die Änderung der Enthalpie zwischen zwei Zuständen, auch Reaktionsenthalpie (∆H) genannt.
- Die Reaktionsenthalpie (∆H) ist eine Bezeichnung für die abgegebene bzw. aufgenommene Wärmeenergie bei einer chemischen Reaktion und wird in kJ/mol angegeben:

- ∆H < 0 = exotherm = Reaktionen bei denen Wärmeenergie abgegeben wird!
- ∆H > 0 = endotherm = Reaktionen bei denen Wärmeenergie benötigt wird!
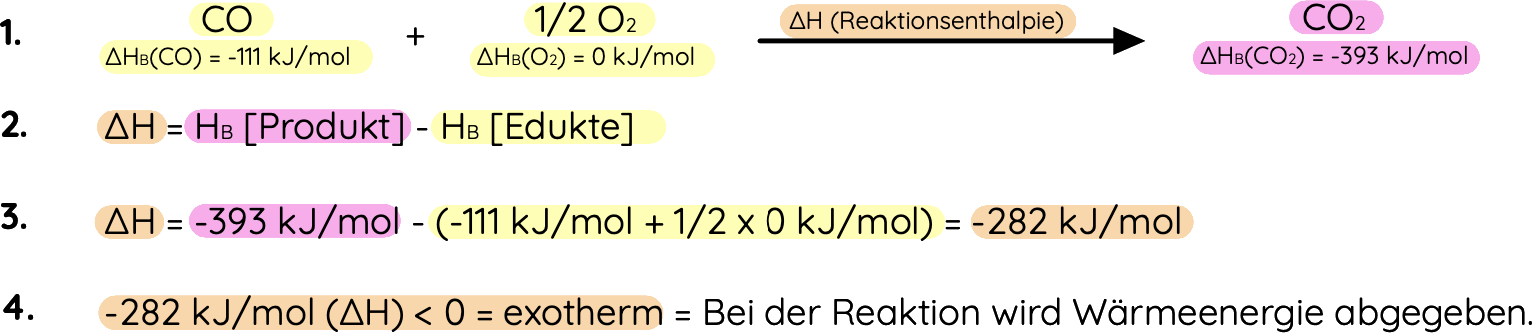
Wie berechnet man die Reaktionsenthalpie?
- In Fachsprache könnte man sagen, dass die Reaktionsenthalpie (∆H) die Differenz zwischen der Standardbildungsenthalpie (∆HB) des Produkts und der Standardbildungsenthalpien (∆HB) der Edukte ist:
![]()
- Für die Berechnung der Reaktionsenthalpie (∆H) müssen wir jetzt nur noch wissen, was Standartbildungsenthalpien (∆HB) überhaupt sind und wie man sie messen kann.
Was ist die Standardbildungsenthalpie?
- Die Standardbildungsenthalpie ist die Wärmeenergie, die bei der Bildung von 1 mol eines Stoffs aus seinen chemischen Elementen gebraucht wird.
- Die Wärmeenergie kann man mit einem sogenannten Kaloriemeter messen bzw. heutzutage einfach im Internet recherchieren, da meist andere die Messungen bereits durchgeführt haben.
Beispiel für die Berechnung von Reaktionsenthalpie