Folge 045 – Freie Enthalpie (G) & Freie Reaktionsenthalpie (∆G) | SW Teil 4 (PDF)
Inhalt der Folge
- Wie wir bereits in Folge 042 gelernt haben, versteht man unter Stoffwechsel die chemischen Reaktionen in einem Organismus.
- In dieser Folge geht es nun darum, wie man ganz allgemein beschreiben kann, ob eine chemische Reaktion freiwillig (ohne äußeren Zwang) ablaufen kann.
Thermodynamik – Die Lehre von Energie und Arbeit
- Die Thermodynamik ist ein Teil der klassischen Physik und beschäftigt sich mit den Zusammenhängen von Energie, Arbeit und Temperatur.
- Die Thermodynamik erlaubt auf Grundlage von ein paar Hauptsätzen und Zustandsgleichungen Aussagen darüber zu treffen, ob chemische Reaktionen aus energetischen Gründen möglich sind oder nicht.
- Ob eine chemischen Reaktionen aus energetischen Gründen freiwillig ablaufen kann oder nicht, wird in der Thermodynamik mit der freien Enthalpie (G) beschrieben.
Freie Enthalpie (G)
- Die freie Enthalpie (G) ist ein Maß für die Triebkraft einer chemische Reaktion und liefert Informationen darüber, ob eine Reaktion freiwillig (ohne äußeren Zwang) ablaufen kann.
- Die physikalische Größe der freien Enthalpie (G) ist Energie.
- Deshalb ist die Einheit der freien Enthalpie (G) natürlich Joule (J).
- Reaktionen die nicht freiwillig ablaufen können, benötigen eine Energiezufuhr, um überhaupt ablaufen zu können.
Freie Reaktionsenthalpie (∆G)
- Die freie Enthalpie (G) eines Zustandes lässt sich nicht messen.
- Gemessen wird die Änderung der freien Enthalpie zwischen zwei Zuständen, also im Verlauf einer Reaktion.
- Die Änderung der freien Enthalpie (G) im Verlauf einer Reaktion nennt man deshalb auch freie Reaktionsenthalpie (∆G).
- Die sogenannte Gibbs-Helmholtz-Gleichung zeigt uns, dass die Änderung der freien Enthalpie (∆G) von der Änderung der Enthalpie (∆H) und der Änderung der Entropie (∆S) im Verlauf einer chemischen Reaktion abhängt.

- ∆G < 0 = exergonisch = Die Reaktion kann freiwillig ablaufen!
- ∆G = 0 = Gleichgewichtszustand = Die Reaktion kann nicht freiwillig ablaufen!
- ∆G > 0 = endergonisch = Die Reaktion kann nicht freiwillig ablaufen!
Was sagt uns die Gibbs-Helmholtz-Gleichung?
Im Grunde genommen vereint die Gibbs-Helmholtz-Gleichung zwei Naturgesetze, die Veränderungen in einem System bewirken:
- Gesetz 1: Ein sich selbst überlassenes System strebt einen möglichst energiearmen Zustand an.
- Dieses Naturgesetzt wird in der Gibbs-Helmholtz-Gleichung mit der Reaktionsenthalpie (∆H) zum Ausdruck gebracht.
- Exotherme Reaktionen führen zu einem energieärmeren Zustand, da hierbei Wärmenergie abgegeben wird.
- Je mehr Wärmenergie bei einer Reaktion abgegeben wird, desto negativer ist der Wert der Reaktionsenthalpie (∆H).
- Und je negativer der Wert der Reaktionsenthalpie (∆H) ist, desto negativer bzw. kleiner ist der Wert der freien Reakionsenthalpie (∆G).
- Und wie wir bereits wissen, muss die freie Reaktionsenthalpie (∆G) negativ sein, damit eine Reaktion freiwillig ablaufen kann.
- Deshalb haben exotherme Reaktionen [∆H < 0] auch eher die Tendenz freiwillig abzulaufen als endotherme Reaktionen [∆H > 0].
- Denn [∆H < 0] führt in der Gibbs-Helmholtz-Gleichung dazu, dass ∆G kleiner wird und [∆H > 0] führt dazu, dass ∆G größer wird.
- Gesetz 2: Ein sich selbst überlassenes System strebt einen Zustand größtmöglicher Unordnung an.
- Dieses Naturgesetzt wird in der Gibbs-Helmholtz-Gleichung mit der Reaktionsentropie (∆S) zum Ausdruck gebracht.
- Je mehr Unordnung bei einer Reaktion erzeugt wird, desto positiver ist der Wert der Reaktionsentropie (∆S).
- Allerdings bedeutet [∆S > 0] in der Gibbs-Helmholtz-Gleichung [(-T · ∆S) < 0].
- Je größer der Wert der Reaktionsentropie (∆S) ist, desto negativer bzw. kleiner ist also der Wert der freien Reaktionsenthalpie (∆G).
- Und wie wir bereits wissen, muss die freie Reaktionsenthalpie (∆G) negativ sein, damit eine Reaktion freiwillig ablaufen kann.
- Deshalb haben Reaktionen, die Unordnung erzeugen [∆S > 0], auch eher die Tendenz freiwillig abzulaufen als Reaktionen, die Ordnung erzeugen [∆S < 0].
- Denn [∆S > 0] führt in der Gibbs-Helmholtz-Gleichung dazu, dass ∆G kleiner wird und [∆S < 0] führt dazu, dass ∆G größer wird.
Exergonische Chemische Reaktionen (∆G < 0)
- Wir wissen, dass die freie Reaktionsenthalpie (∆G) negativ sein muss, damit eine Reaktion freiwillig ablaufen kann.
- Auf mathematischer Ebene muss (∆H – T · ∆S) also insgesamt negativ sein.
- Bei diesen drei Szenarien ist dies der Fall (A = Ausgangszustand der Reaktion; E = Endzustand der Reaktion):
- Exotherme Reaktionen (∆H < 0) bei denen Unordnung erzeugt wird (∆S > 0).
- Denk dran, dass [∆S > 0] in der Gibbs-Helmholtz-Gleichung [(-T · ∆S) < 0] ist.
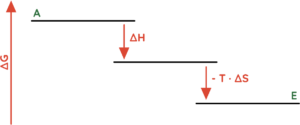
- Denk dran, dass [∆S > 0] in der Gibbs-Helmholtz-Gleichung [(-T · ∆S) < 0] ist.
- Endotherme Reaktionen (∆H > 0) bei denen ausreichend Unordnung erzeugt wird (∆S > 0).
- (∆G < 0) ist möglich, wenn (-T · ∆S) negativ ist und wenn der Betrag von (-T · ∆S) größer ist als der Betrag von ∆H.
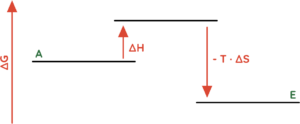
- (∆G < 0) ist möglich, wenn (-T · ∆S) negativ ist und wenn der Betrag von (-T · ∆S) größer ist als der Betrag von ∆H.
- Exotherme Reaktionen (∆H < 0), bei denen etwas Ordnung erzeugt wird (∆S < 0).
- Denk dran, dass [∆S < 0] in der Gibbs-Helmholtz-Gleichung [(-T · ∆S) > 0] ist, da Minus mal Minus mathematisch Plus ergibt.
- (∆G < 0) ist möglich, wenn ∆H negativ ist und wenn der Betrag von ∆H größer ist als der Betrag von (-T · ∆S).
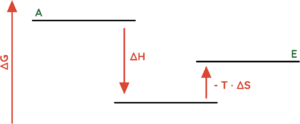
Endergonische Chemische Reaktionen (∆G > 0)
- Wir wissen, dass die freie Reaktionsenthalpie (∆G) positiv sein muss, damit eine Reaktion nicht freiwillig ablaufen kann.
- Auf mathematischer Ebene muss (∆H – T · ∆S) also insgesamt positiv sein.
- Bei diesen drei Szenarien ist dies der Fall (A = Ausgangszustand der Reaktion; E = Endzustand der Reaktion):
- Endotherme Reaktionen (∆H > 0) bei denen Ordnung erzeugt wird (∆S < 0).
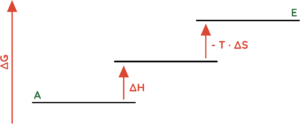
- Endotherme Reaktionen (∆H > 0) bei denen nicht ausreichend Unordnung (∆S > 0).
- (∆G > 0) ist gegeben, wenn der Betrag von (-T · ∆S) kleiner ist als der Betrag von ∆H.
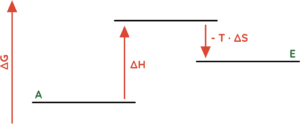
- (∆G > 0) ist gegeben, wenn der Betrag von (-T · ∆S) kleiner ist als der Betrag von ∆H.
- Exotherme Reaktionen (∆H < 0), bei denen sehr viel Ordnung erzeugt wird (∆S < 0).
- (∆G > 0) ist gegeben, wenn (-T · ∆S) positiv ist und wenn der Betrag von (-T · ∆S) größer ist als der Betrag von ∆H.
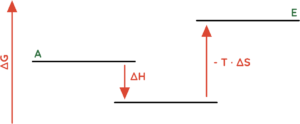
- (∆G > 0) ist gegeben, wenn (-T · ∆S) positiv ist und wenn der Betrag von (-T · ∆S) größer ist als der Betrag von ∆H.
Der Einfluss der Temperatur auf die freie Enthalpie (G)
- Wenn man die Gibbs-Helmholtz-Gleichung betrachtet (∆G = ∆H – T · ∆S), sieht man natürlich direkt, dass die Temperatur (T) auch ein Rolle spielt.
- Zunächst müsst ihr euch merken, dass die Temperatur in dieser Gleichung als absolute Temperatur angegeben werden muss.
- Die Temperatur wird also nicht in Grad Celsius (°C), sondern in Kelvin (K) angegeben.
- Für die Berechnung von ∆G ist das deshalb interessant, weil der absolute Nullpunkt bei 0 Kelvin liegt (= -273,15 °C).
- In der Gibbs-Helmholtz-Gleichung kann T also nicht negativ sein.
- Je höher T ist, desto größer ist auch der Betrag von (-T · ∆S) und das kann sich in manchen Fällen wiederum darauf auswirken, ob ∆G positiv oder negativ ist.
- Ein Beispiel:
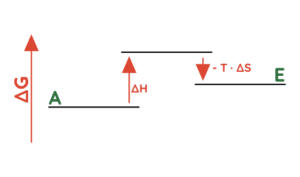
- Die Temperatur kann zum Beispiel eine entscheidende Rolle bei endothermen Reaktionen (∆H > 0) spielen, bei denen Unordnung erzeugt wird (∆S > 0):
-
- Die Temperatur ist niedrig (T ist klein) = ∆G > 0 = endergonisch
- Die Temperatur ist hoch (T ist groß) = ∆G < 0 = exergonisch
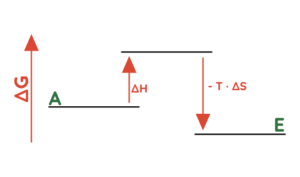
- Die Temperatur ist niedrig (T ist klein) = ∆G > 0 = endergonisch
